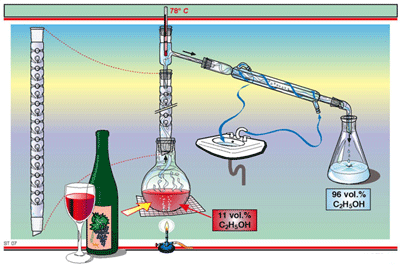
เนื่องจากปัจจุบันนักเคมีพบว่า การจัดเรียงตัวของอิเล็กตรอนในอะตอมของธาตุมีส่วนสัมพันธ์กับสมบัติต่าง ๆ ของธาตุ กล่าวคือ ถ้าเรียงลำดับธาตุตามเลขอะตอมจากน้อยไปหามาก จะพบว่าธาตุที่มีสมบัติคล้ายคลึงกันเป็นช่วง ๆ ตามลักษณะของการจัดเรียงอิเล็กตรอนในอะตอมของธาตุนั้น ดังนั้นในปัจจุบันจึงจัดตารางธาตุโดยเรียงตามเลขอะตอมจากน้อยไปมาก
ตารางธาตุในปัจจุบัน
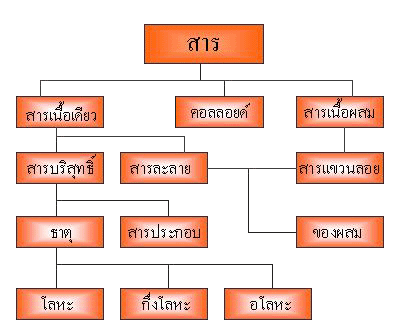
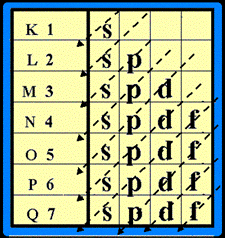
ตารางธาตุในรูปนี้เป็นแบบที่ใช้กันอยู่มากในปัจจุบัน แบ่งธาตุในแนวตั้งออกเป็น 18 แถวหรือ 18 หมู่ โดยธาตุทั้งหมด 18 แถว แบ่งเป็น 2 กลุ่มใหญ่ ๆ คือกลุ่ม A และ B กลุ่ม A มี 8 หมู่ คือหมู่ IA ถึง VIIIA ส่วนกลุ่ม B ซึ่งอยู่ระหว่างหมู่ IIA และ IIIA มี 8 หมู่เช่นเดียวกัน คือ หมู่ IB ถึง VIIIB (แต่มี 10 แนวตั้ง) เรียกธาตุกลุ่ม B ว่า ธาตุทรานซิชัน
ธาตุในแต่ละหมู่ ของกลุ่ม A ถ้ามีสมบัติคล้ายกันจะมีชื่อเรียกเฉพาะหมู่ เช่น
ธาตุหมู่ IA เรียกว่า โลหะอัลคาไล (alkali metal) ได้แก่ Li , Na , K , Rb , Cs , Fr
ธาตุหมู่ IIA เรียกว่า โลหะอัลคาไลน์เอิร์ท (alkaline earth) ได้แก่ Be Mg Ca Sr Ba Ra
ธาตุหมู่ VIIA เรียกว่า ธาตุเฮโลเจน (halogen) ได้แก่ F Cl Br I At
ธาตุหมู่ที่ VIIIA เรียกว่า ก๊าซเฉื่อย (Inert gas) ได้แก่ He Ne Ar Kr Xe Rn
สำหรับการแบ่งธาตุเป็นคาบ ธาตุทั้งหมดในตารางธาตุแบ่งเป็น 7 คาบ ซึ่งในแต่ละคาบอาจจะมีจำนวนธาตุไม่เท่ากัน เช่น
สำหรับคาบต่าง ๆ ในตารางธาตุแบ่งเป็น 7 คาบดังนี้
คาบที่ 1 มี 2 ธาตุ คือ H , He
คาบที่ 2 มี 8 ธาตุ คือ ตั้งแต่ Li ถึง Ne
คาบที่ 3 มี 8 ธาตุ คือ ตั้งแต่ Na ถึง Ar
คาบที่ 4 มี 18 ธาตุ คือ ตั้งแต่ K ถึง Kr
คาบที่ 5 มี 18 ธาตุ คือ ตั้งแต่ Rb ถึง Xe
คาบที่ 6 มี 32 ธาตุ คือ ตั้งแต่ Cs ถึง Rn
คาบที่ 7 มี 19 ธาตุ คือ ตั้งแต่ Fr ถึง Ha
รวมทั้งหมด 105 ธาตุ เป็นก๊าซ 11 ธาตุ คือ H , N , O , F , Cl , He , Ne , Ar , Kr , Xe และ Rn เป็นของเหลว 5 ธาตุ คือ Cs , Fr , Hg , Ga และ Br ที่เหลือเป็นของแข็ง
สำหรับ 2 แถวล่างเลขอะตอม 58 - 71 และ 90 - 103 เป็นธาตุกลุ่มย่อยที่แยกมาจากหมู่ IIIB ในคาบที่ 6 และ 7 เรียกธาตุในกลุ่มย่อยนี้รวม ๆ ว่า กลุ่มธาตุเลนทาไนด์ และกลุ่มธาตุแอกทิไนด์
นอกจากนี้เมื่อพิจารณาธาตุหมู่ IIIA ไปทางขวามือ จะพบเส้นหนักหรือเส้นทึบเป็นแบบขั้นบันได เส้นหนักนี้จะเป็นเส้นแบ่งกลุ่มธาตุโลหะและอโลหะ กล่าวคือ ธาตุทางขวาของเส้นขั้นบันไดจะเป็นอโลหะ ธาตุทางซ้ายมือของเส้นขั้นบันไดจะเป็นโลหะ ธาตุที่อยู่ชิดกับเส้นขั้นบันได เป็นธาตุกึ่งโลหะ ซึ่งมีทั้งสมบัติของโลหะและอโลหะ เช่น ธาตุ B , Si , Ge , As , Sb , Te
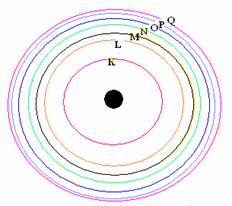
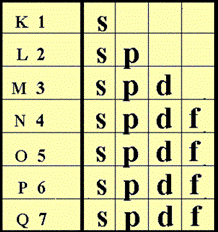
การจัดเรียงอิเล็กตรอนกับหมู่และคาบของธาตุ
จากการพิจารณาการจัดเรียงอิเล็กตรอนของธาตุ พบว่ามีส่วนสัมพันธ์กับการจัดหมู่และคาบของตารางธาตุในปัจจุบัน
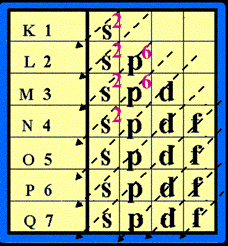
สำหรับธาตุกลุ่ม A ธาตุที่อยู่ในหมู่เดียวกันจะมีเวเลนซ์อิเล็กตรอนเท่ากัน จำนวนเวเลนซ์อิเล็กตรอนของธาตุในแต่ละหมู่จะตรงกับเลขประจำหมู่
จำนวนระดับพลังงานที่มีอิเล็กตรอนอยู่ จะเท่ากับเลขที่คาบ นั่นคือธาตุที่อยู่ในคาบเดียวกันจะมีจำนวนระดับพลังงานเท่ากัน
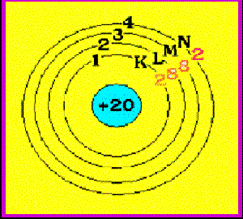
เช่น 11Na = 2 , 8 , 1
12Mg = 2 , 8 , 2
19K = 2 , 8 , 8 , 1
ทั้ง Na และ K ต่างก็มีเวเลนซ์อิเล็กตรอนเท่ากัน แสดงว่าเป็นธาตุในหมู่เดียวกัน เนื่องจากมี 1 เวเลนซ์อิเล็กตรอน จึงจัดเป็นธาตุหมู่ที่ 1 เหมือนกัน
Na มี 3 ระดับพลังงาน จึงจัดอยู่ในคาบที่ 3 ของตารางธาตุ
K มี 4 ระดับพลังงานจึงจัดอยู่ในคาบที่ 4 ของตารางธาตุ
Mg มี 3 ระดับพลังงานจึงจัดอยู่ในคาบที่ 3 ของตารางธาตุ
ดังนั้น Na และ Mg จัดเป็นธาตุที่อยู่ในคาบเดียวกันคือคาบที่ 3 แต่ต่างหมู่กันเพราะมีเวเลนต์อิเล็กตรอนต่างกัน คือ หมู่ 1A และ 2A ตามลำดับ
การตั้งชื่อธาตุที่ค้นพบใหม่
จากตารางธาตุในรูปที่ 5.13 จะพบว่ามีธาตุอยู่ 106 ธาตุ ซึ่งยังมีการค้นพบธาตุใหม่ ๆ เพิ่มขึ้นอีกหลายธาตุ แต่ยังไม่ได้กำหนดสัญลักษณ์ที่แน่นอนไว้ในตารางธาตุ ธาตุบางธาตุถูกค้นพบโดยนักวิทยาศาสตร์หลายคณะ ทำให้มีชื่อเรียกและสัญลักษณ์ต่างกัน
เช่น ธาตุที่ 104 ค้นพบโดยคณะนักวิทยาศาสตร์ 2 คณะ คือ คณะของนักวิทยาศาสตร์สหรัฐอเมริกา ซึ่งเรียกชื่อว่า รัทเทอร์ฟอร์เดียม (Ratherfordium) และใช้สัญลักษณ์ Rf ในขณะที่คณะนักวิทยาศาสตร์สหภาพโซเวียตเรียกชื่อว่าเคอร์ซาโตเวียม (Kurchatovium) และใช้สัญลักษณ์ Ku
ธาตุที่ 105 ค้นพบโดยคณะนักวิทยาศาสตร์ 2 คณะเช่นเดียวกัน คือคณะนักวิทยาศาสตร์สหรัฐอเมริกาเรียกชื่อว่า ฮาห์เนียม (Hahnium) และใช้สัญลักษณ์ Ha ในขณะที่นักวิทยาศาสตร์สหภาพโซเวียตใช้ชื่อว่า นิลส์บอห์เรียม (Neilbohrium) และใช้สัญลักษณ์เป็น Ns
การที่คณะนักวิทยาศาสตร์ต่างคณะตั้งชื่อแตกต่างกัน ทำให้เกิดความสับสน International Union of Pure and Applied Chemistry (IUPAC) จึงได้กำหนดระบบการตั้งชื่อขึ้นใหม่ โดยใช้กับชื่อธาตุที่มีเลขอะตอมเกิน 100 ขึ้นไป ทั้งนี้ให้ตั้งชื่อธาตุโดยระบุเลขอะตอมเป็นภาษาละติน แล้วลงท้ายด้วย ium
ระบบการนับเลขในภาษาละตินเป็นดังนี้
0 = nil (นิล) 1 = un (อุน)
2 = bi (ไบ) 3 = tri (ไตร)
4 = quad (ควอด) 5 = pent (เพนท์)
6 = hex (เฮกซ์) 7 = sept (เซปท์)
8 = oct (ออกตฺ) 9 = enn (เอนน์)
เช่น
ธาตุที่ 104 ตามระบบ IUPAC อ่านว่า อุนนิลควอเดียม (Unnilquadium) สัญลักษณ์ Unq
ธาตุที่ 105 ตามระบบ IUPAC อ่านว่า อุนนิลเพนเทียม (Unnilpentium) สัญลักษณ์ Unp
การจัดตารางธาตุเป็นหมู่เป็นคาบ ทำให้ศึกษาสมบัติต่าง ๆ ของธาตุได้ง่ายขึ้น สามารถทำนายสมบัติบางประการของธาตุบางธาตุได้ กล่าวคือธาตุที่อยู่ในหมู่เดียวกันจะมีสมบัติต่าง ๆ คล้าย ๆ กัน และธาตุที่อยู่ในคาบเดียวกัน จะมีแนวโน้มของการเปลี่ยนแปลงสมบัติต่าง ๆ ต่อเนื่องกันไป
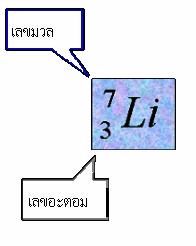
 อะตอมและตารางธาตุ
อะตอมและตารางธาตุ